
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO(g)═C(s)+$\frac{1}{2}$O2(g) | B. | 2N2O5(g)═4NO2(g)+O2(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
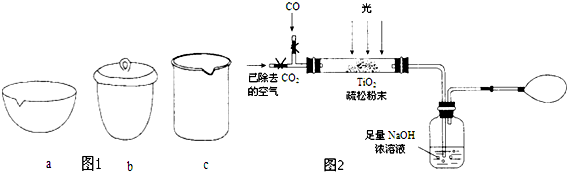
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO(NH2)2 | B. | (NH4)2CO3 | C. | NH4NO3 | D. | CH3COONH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com