
科目: 来源: 题型:选择题
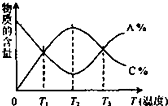 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 升高温度,平衡会向正反应方向移动 | |
| C. | 该反应的逆反应是放热反应 | |
| D. | 该反应在T2温度时达到化学平衡 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
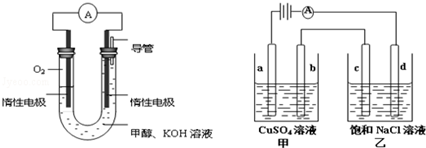
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| X | Y | Z | |
| W |
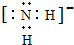
查看答案和解析>>
科目: 来源: 题型:选择题
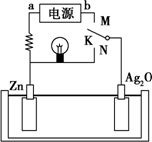 如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )| A. | 放电时的负极反应和充电时的阴极反应属于可逆反应 | |
| B. | 在电池放电过程中溶液的pH增大 | |
| C. | K与N相接时,能量由化学能转化为电能,溶液中的OH-向正极区移动 | |
| D. | K与M连接时,所用电源的a极为负极,阳极附近溶液的pH逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
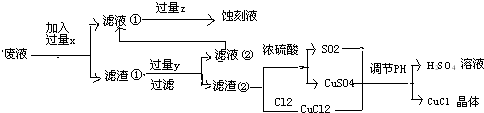
 磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:
磷单质及其化合物在工业上有广泛应用.磷最重要的矿物资源是磷灰石,磷灰石主要有氟 磷灰石和羟基磷灰石.氟磷灰石在高温下制备白磷的化学方程式为:4Ca5 (P04)3F+21Si02+30C═3P4+20CaSi03+30CO+SiF4,结合上述反应中涉及到的物质或元素回答相关问题:查看答案和解析>>
科目: 来源: 题型:解答题
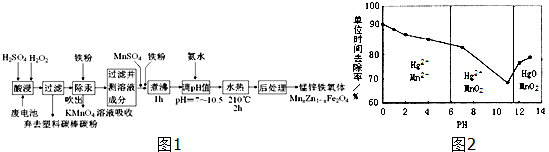
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
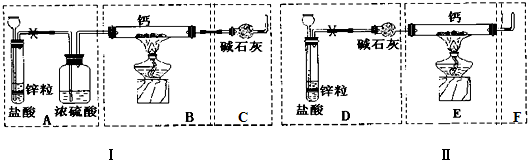
 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象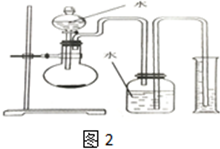
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com