
科目: 来源:浙江省模拟题 题型:填空题
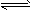 xC(g),
xC(g),查看答案和解析>>
科目: 来源:浙江省模拟题 题型:填空题
 CaO+2HBr
CaO+2HBr HgBr2+H2
HgBr2+H2  ______
______  Hg+O2↑
Hg+O2↑ 
 CO2(g)+H2(g) △H<0 在850℃时,
CO2(g)+H2(g) △H<0 在850℃时,查看答案和解析>>
科目: 来源:江西省模拟题 题型:单选题
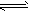 2Z(g),要使平衡时反应物总物质的量与生成物的物质的量相等。若最初时只加入X、Y两种物质,则X、Y的初始物质的量之比的范围应满足
2Z(g),要使平衡时反应物总物质的量与生成物的物质的量相等。若最初时只加入X、Y两种物质,则X、Y的初始物质的量之比的范围应满足 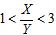
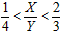
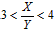
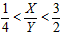
查看答案和解析>>
科目: 来源:专项题 题型:单选题
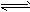 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是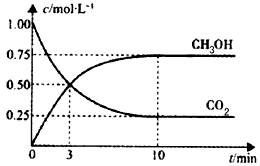
 增大
增大查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:专项题 题型:填空题
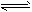 CH3OH(g) △H1
CH3OH(g) △H1 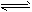 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2 

查看答案和解析>>
科目: 来源:江西省模拟题 题型:单选题
 CH3OH(g)+ H2O(g) △H<0。500℃时,在固定容积为1 L的密闭容器中充入1 mol CO2、3 mol H2,测得CO2浓度与甲醇浓度随时间的变化如图所示。从中得出的下列结论中错误的是
CH3OH(g)+ H2O(g) △H<0。500℃时,在固定容积为1 L的密闭容器中充入1 mol CO2、3 mol H2,测得CO2浓度与甲醇浓度随时间的变化如图所示。从中得出的下列结论中错误的是 
查看答案和解析>>
科目: 来源:0114 模拟题 题型:单选题
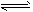 H2O(g) +CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是
H2O(g) +CO(g)的平衡常数K=9/4。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 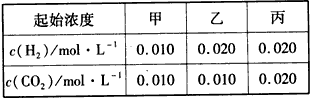
查看答案和解析>>
科目: 来源:湖南省模拟题 题型:填空题
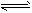 3C(s)+ 4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol/L。请填写下列空白:
3C(s)+ 4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol/L。请填写下列空白:查看答案和解析>>
科目: 来源:模拟题 题型:单选题
 SO2Cl2(l),在某密闭容器中加入16. 20g氯化硫酰,达到平衡时容器中含SO2 7.616 g。反应后将平衡混合物溶于足量的BaCl2溶液中,则最终生成沉淀的质量
SO2Cl2(l),在某密闭容器中加入16. 20g氯化硫酰,达到平衡时容器中含SO2 7.616 g。反应后将平衡混合物溶于足量的BaCl2溶液中,则最终生成沉淀的质量 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com