
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO-3+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液;2Fe3++2I-═2Fe2++I2 | |
| C. | Na2S203溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用热的纯碱溶液清除灶具上的油污 | |
| B. | 用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用明矾[KAl(SO4)2•12H2O]作净水剂,除去水中悬浮的杂质 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol 氧气的质量为32g | |
| B. | 常温常压下,1mol CO2气体体积约为22.4L | |
| C. | CO2的摩尔质量为44g/mol | |
| D. | 1L 2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
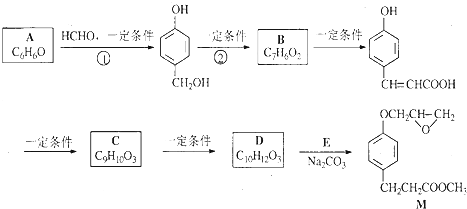
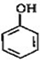 B
B C
C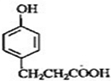
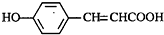 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.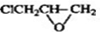 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式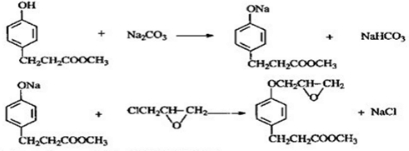 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com