
科目: 来源: 题型:选择题
| A. | 某反应的焓变小于零,该反应一定能自发进行 | |
| B. | 用湿润的PH试纸测稀盐酸溶液的pH为3.52 | |
| C. | 原电池是将化学能转变为电能的装置 | |
| D. | 草木灰(K2CO3)是钾肥,硫酸铵是氮肥,两者混合施用可以提高肥效 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 开始蒸馏时,应该先通冷凝水,再加热;蒸馏完毕,应该先撤酒精灯再停通冷凝水 | |
| C. | 使用托盘天平称量物质时,先取小砝码,再依次取较大的砝码 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
查看答案和解析>>
科目: 来源: 题型:填空题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

查看答案和解析>>
科目: 来源: 题型:填空题
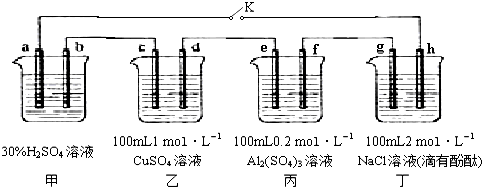
 如图甲、乙是电化学实验装置.请回答下列问题:
如图甲、乙是电化学实验装置.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
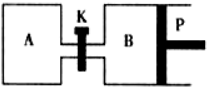 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目: 来源: 题型:解答题
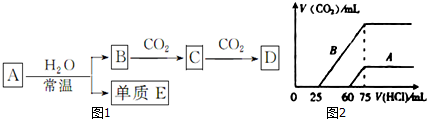
查看答案和解析>>
科目: 来源: 题型:解答题
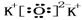 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com