
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域 | |
| B. | iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阴极的金属铝纯度不够,导致氧化膜不够致密 | |
| C. | 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂的原料 |
查看答案和解析>>
科目: 来源: 题型:解答题
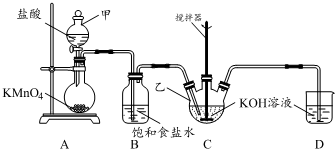 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目: 来源: 题型:选择题
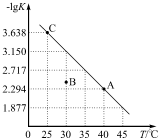 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示.下列说法不正确的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示.下列说法不正确的是( )| A. | 该反应的△H>0 | |
| B. | 30℃时,B点对应状态的v(正)<v(逆) | |
| C. | A点对应状态的平衡常数K(A)=10-2.294 | |
| D. | NH3的体积分数不变时,该反应一定达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
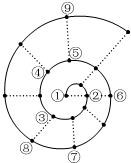 如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )| A. | 最简单气态氢化物的稳定性:③比⑧强、⑤比⑨弱 | |
| B. | 最高价氧化物对应水化物的碱性:②比⑥强 | |
| C. | ⑦的最高价氧化物对应的水化物具有两性 | |
| D. | 简单离子半径④比⑥小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 LBr2所含溴原子的数目为2NA | |
| B. | 常温下,NO2与足量的水反应生成0.1molNO,转移的电子数为0.2NA | |
| C. | 1 mol 乙醇中含有的C-H键的数目为6NA | |
| D. | 1mol•L-1的NaClO溶液中含有的ClO-数目小于NA |
查看答案和解析>>
科目: 来源: 题型:解答题
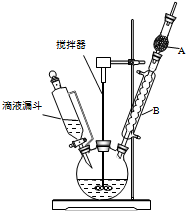 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇[ | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应的氧化剂为KMnO4 | |
| B. | 发生还原反应的是H2C2O4 | |
| C. | 该离子方程式右侧方框内的产物是H2O | |
| D. | 6mol H+参加反应时,电子转移10mol |
查看答案和解析>>
科目: 来源: 题型:选择题
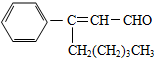 关于茉莉醛的下列叙述不正确的是 (?)
关于茉莉醛的下列叙述不正确的是 (?)| A. | 茉莉醛能使溴水褪色 | |
| B. | 在加热和催化剂作用下,能被氢气还原生成一种芳香醇 | |
| C. | 一定条件下,能被银氨溶液、新制氢氧化铜等多种氧化剂氧化 | |
| D. | 不能与氢溴酸发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com