
科目: 来源: 题型:选择题
| A. |  装置用于检验消去产物 | B. | 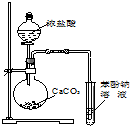 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 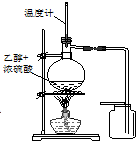 装置用于实验室制取并收集乙烯 | D. | 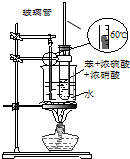 装置用于实验室制硝基苯 |
查看答案和解析>>
科目: 来源: 题型:解答题
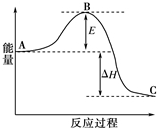 合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
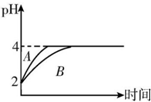 已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:
已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
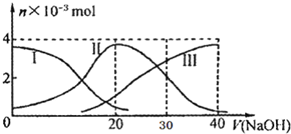 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2 c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)a=-1453.28 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCLO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
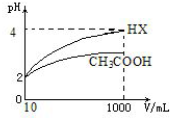
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com