
科目: 来源: 题型:解答题
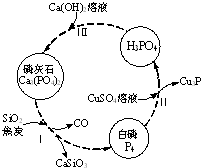 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
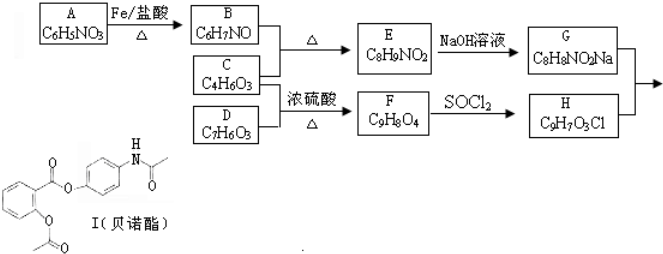
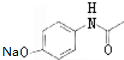 .
.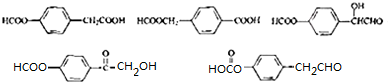 (其中的三种).
(其中的三种).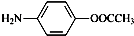 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.查看答案和解析>>
科目: 来源: 题型:解答题
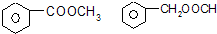 .
.查看答案和解析>>
科目: 来源: 题型:解答题
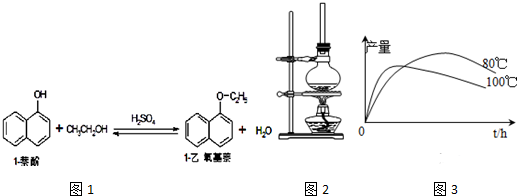
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
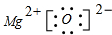 .
.| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com