
科目: 来源: 题型:解答题
 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.查看答案和解析>>
科目: 来源: 题型:解答题
 2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图.
2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图. ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)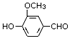 )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
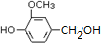 .
.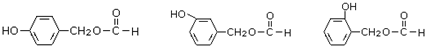 (其中之一).
(其中之一). 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).已知:羰基α-H可发生反应:
查看答案和解析>>
科目: 来源: 题型:解答题
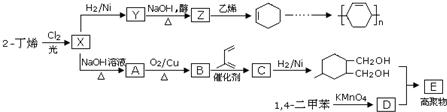
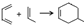 .
.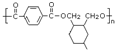 ;甲是A的一种同分异构体,其能实现转化:
;甲是A的一种同分异构体,其能实现转化: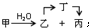 ,甲的名称为乙酸乙酯;
,甲的名称为乙酸乙酯;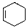 可以合成
可以合成 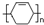 .按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.
.按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.查看答案和解析>>
科目: 来源: 题型:解答题
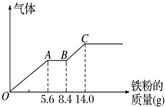
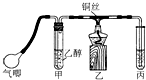 利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).
利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).查看答案和解析>>
科目: 来源: 题型:解答题
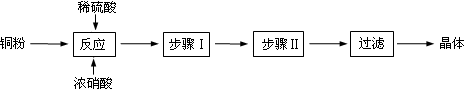
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
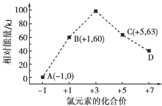 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 相对分子质量 | 87 | 67.5 | 183 |
| 沸点/℃ | 2 | 9.7 | 81 |
 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | n(FeO):n(Fe3O4)=1:1 | B. | n(Fe2O3):n(FeO)=2:1 | ||
| C. | n(Fe2O3):n(FeO)=1:2 | D. | n(Fe2O3):n(Fe3O4)=1:1 |
查看答案和解析>>
科目: 来源: 题型:多选题
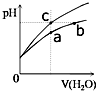 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、b、c三点溶液的离子浓度之和a>b>c | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目: 来源: 题型:多选题
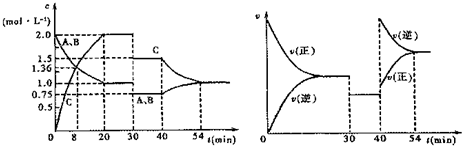
| A. | 反应方程式中的x=1 | |
| B. | 该反应为放热反应 | |
| C. | 30 min时改变的条件是加入催化剂 | |
| D. | 前30 min内A的反应速率为0.05 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com