
科目: 来源: 题型:选择题
| A. | AlCl3 | B. | KCl | C. | CaCl2 | D. | LiCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
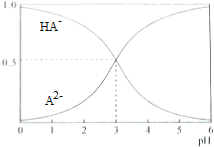
| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
查看答案和解析>>
科目: 来源: 题型:解答题
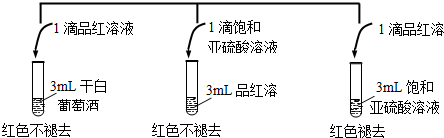
查看答案和解析>>
科目: 来源: 题型:解答题
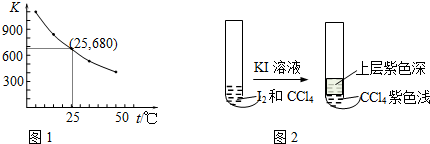
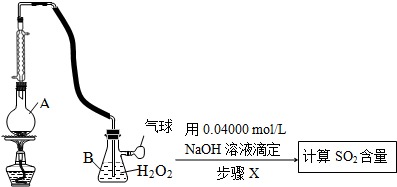
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.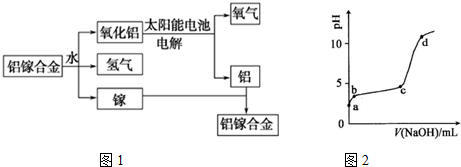
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
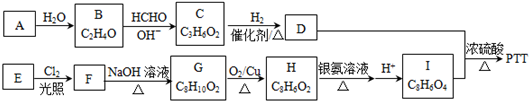
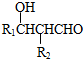
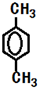 .
. .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为:2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O | |
| C. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O═4Fe3++20OH-+3O2↑ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-═FeO42-+4H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 溶液中OH?氧化了Mg |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中Mg也可被氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com