
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
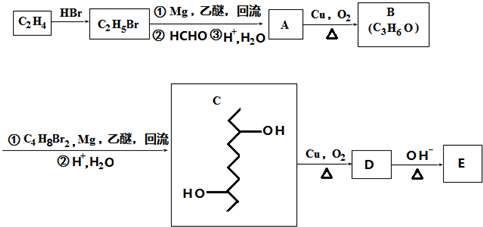
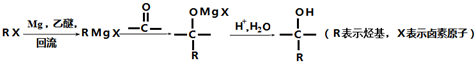

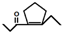 ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式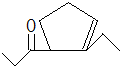 、
、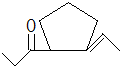 .
.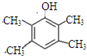 或
或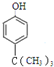
查看答案和解析>>
科目: 来源: 题型:解答题
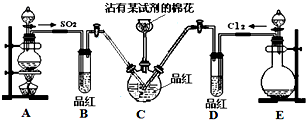 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.查看答案和解析>>
科目: 来源: 题型:解答题
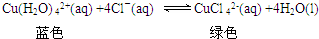
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
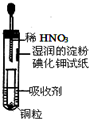
| A. | 吸收剂可以是NaOH溶液 | B. | 试管上部的气体始终为无色 | ||
| C. | 小试管中溶液最终呈蓝色 | D. | 试纸先变红后褪色 |
查看答案和解析>>
科目: 来源: 题型:多选题
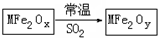 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )| A. | x<y | B. | SO2是该反应的催化剂 | ||
| C. | MFe2Ox是还原剂 | D. | 氧化性:MFe2Oy>SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com