
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 锌电极发生还原反应:铜电极发生氧化反应 | |
| B. | 铜电极做正极发生的电极反应为:2H++2e-═H2↑ | |
| C. | 当有13g Zn溶解时,电路中就有0.5mol电子通过 | |
| D. | 电子从锌电极通过电流表流向铜电极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子结构示意图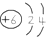 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式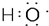 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、NO3-,可能有NH4+、K+ | |
| B. | 肯定有Al3+、K+、Cl-,肯定没有MnO4-、Mg2+ | |
| C. | 肯定有Al3+、NH4+、Cl-、NO3-,一定没有HCO3-、Mg2+、MnO4- | |
| D. | 该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
科目: 来源: 题型:选择题
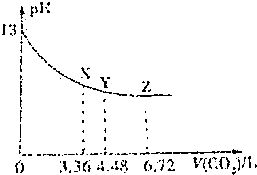
| A. | 该NaOH溶液的浓度为0.1mol/L,体积为6L | |
| B. | X、Y、Z三点对应的溶液中离子的种类不同 | |
| C. | Y点对应的融资中离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| D. | Y点对应的溶液中存在着:c(Na+)=2c(HCO3-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3v(H2)正=2v(NH3)逆 | B. | 容器内的总压强不再随时间而变化 | ||
| C. | N2、H2、NH3的分子数之比为1:3:2 | D. | 混合气体的密度不再随时间变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
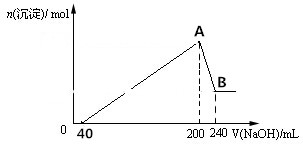
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶. | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知度的盐酸时,选用酚酞作指示剂,实验时不小心多加了几滴 | |
| D. | 用标准盐酸测定未知浓度NaOH结束实验,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com