
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ③② | C. | ③① | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:解答题
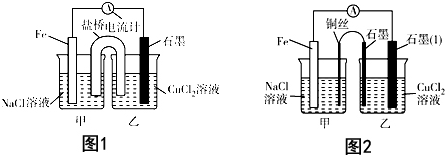

查看答案和解析>>
科目: 来源: 题型:解答题
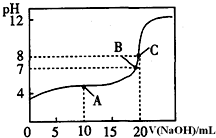 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
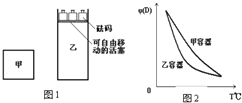 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g);△H<0.现将2molA和2mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )| A. | 甲容器中的反应先达到化学平衡状态 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 | |
| C. | 两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度和乙中物质C的浓度相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水溶液等体积混合:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| D. | Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:填空题
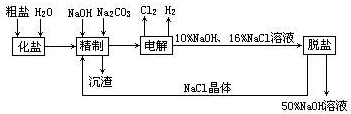
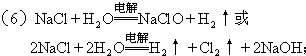 .
.查看答案和解析>>
科目: 来源: 题型:填空题
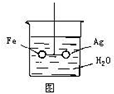 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com