
科目: 来源: 题型:解答题
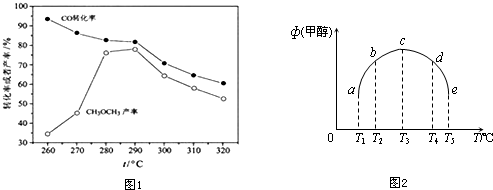
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蔗糖及其水解产物均能发生银镜反应 | |
| B. | 用酸性KMnO4溶液即可鉴别2-丁烯和正丁醛 | |
| C. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| D. | 用甘氨酸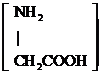 和丙氨酸 和丙氨酸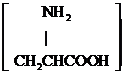 缩合最多可形成3种二肽 缩合最多可形成3种二肽 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,且半分钟不变色 | |
| B. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口放出,重复2~3次 | |
| D. | 用标准NaOH溶液滴定盐酸,滴定管尖嘴部分在滴定前无气泡,滴定终点时出现气泡,则测定结果将偏大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熟石灰与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| B. | 人造纤维是利用自然界的非纤维材料通过化学合成方法得到的 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” |
查看答案和解析>>
科目: 来源: 题型:解答题

| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
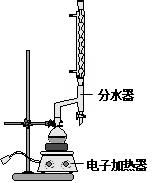
查看答案和解析>>
科目: 来源: 题型:解答题
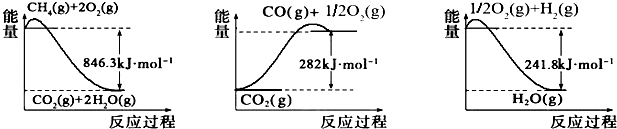
查看答案和解析>>
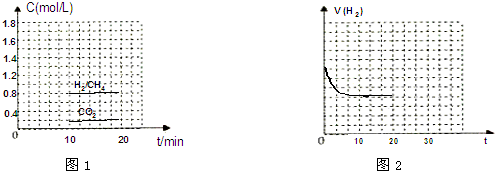
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
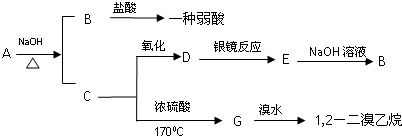
 2CH3CHO+2H2O.
2CH3CHO+2H2O.查看答案和解析>>
科目: 来源: 题型:选择题
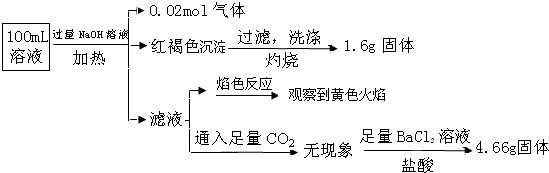
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | |
| B. | CH3COOH 溶液加水稀释后,溶液中c(H+)/c(CH3COO-) 的值减小 | |
| C. | 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com