
科目: 来源: 题型:选择题
| A. | 纪录片《穹顶之下》中的雾霾属于小颗粒纳米级聚合物,我们可利用丁达尔现象鉴别 | |||||||
| B. | 安装煤炭“固硫”、“脱硝”装置,可以有效避免“穹顶”出现的概率 | |||||||
| C. | 我国是煤多油少的国家,煤层气俗称瓦斯气,是一种新利用的能源,煤层气相比直接烧煤更清洁,利于对抗雾霾 | |||||||
| D. | 下表为全国主要机场机场2014年PM2.5均值,PM2.5口罩材质为碳纤维毡垫、高分子织物、无纺布等,是一种间隙比半透膜还小的分子筛.
|
查看答案和解析>>
科目: 来源: 题型:解答题
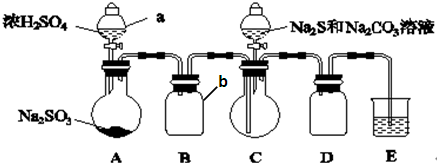
查看答案和解析>>
科目: 来源: 题型:解答题

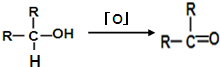
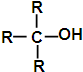

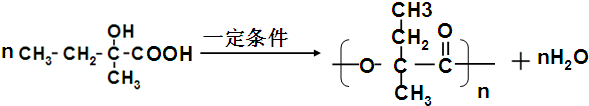
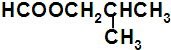 、
、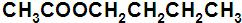 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | B元素所形成的单质的晶体类型都是相同的 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 燃料电池制作中,为了能吸附更多气体,在两根碳棒表面包上一层薄海绵 | |
| C. | 用硫代硫酸钠溶液和硫酸溶液反应测反应速率是实验中,可以通过判断气泡多少来比较反应速率快慢 | |
| D. | 酸碱中和滴定操作中,用酸润洗过的滴定管需要用蒸馏水再润洗一次 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠钾合金可用作快中子反应堆导热剂的原因之一是常温下呈液态 | |
| B. | 我国航天员穿的航天服使用的高强度、高韧性的特种尼龙,是一种有机高分子合成材料 | |
| C. | 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 | |
| D. | 用氢作汽车燃料,用燃料电池作动力,合成可再生的储氢材料,可以实现汽车的“零排放” |
查看答案和解析>>
科目: 来源: 题型:解答题
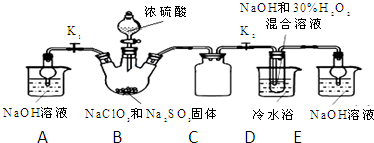
查看答案和解析>>
科目: 来源: 题型:解答题
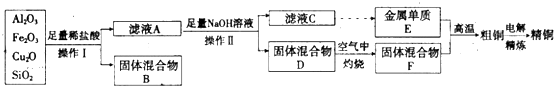
查看答案和解析>>
科目: 来源: 题型:选择题

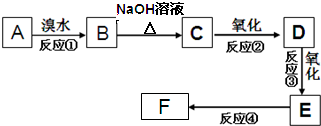
| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用蒸馏水吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发结晶、冷却、过滤、洗涤 |
查看答案和解析>>
科目: 来源: 题型:选择题
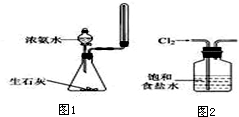
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 用量筒量取20 mL 0.5000 mol•L-1H2SO4溶液于烧杯中,加水80mL配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 实验室用图1所示装置制取少量氨气 | |
| D. | 实验室用图2所示装置除去Cl2中的少量HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com