
科目: 来源: 题型:选择题
| A. | Na2CO3═2Na++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KOH═K++O2-+H+ | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
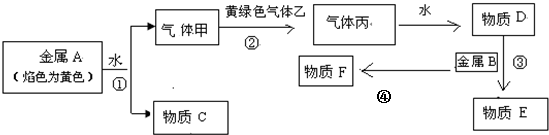
查看答案和解析>>
科目: 来源: 题型:解答题
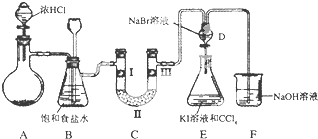
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④ | B. | ③⑥ | C. | ①③ | D. | ②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com