
科目: 来源: 题型:选择题
| A. | 生成物的百分含量一定增加 | B. | 正反应速率大于逆反应速率 | ||
| C. | 反应物的转化率一定增大 | D. | 反应物浓度一定降低 |
查看答案和解析>>
科目: 来源: 题型:多选题
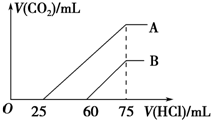 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L-1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )| A. | 在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3 | |
| B. | B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况) | |
| C. | 原NaOH溶液的物质的量浓度为0.100mol/L | |
| D. | B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
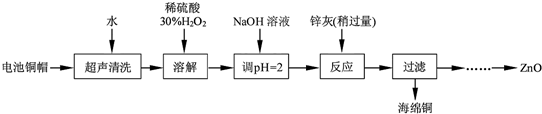
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有②③ | B. | 只有③④ | C. | 都正确 | D. | 都错误 |
查看答案和解析>>
科目: 来源: 题型:选择题
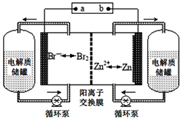 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| B. | 放电时正极的电极反应式为Br2+2e-═2Br- | |
| C. | 充电时电极b连接电源的正极 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准液滴定待测液,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 中和热测定实验中,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用浓H2SO4刻蚀工艺玻璃上的纹饰 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (10-8+10-10)mol•L-1 | B. | (10-4+10-6)mol•L-1 | ||
| C. | (10-6+10-10)mol•L-1 | D. | 2×10-10 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池是把电能转变为化学能的装置 | |
| B. | 原电池中电子流出的一极是负极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,原电池中的阳离子向负极方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com