
科目: 来源: 题型:解答题
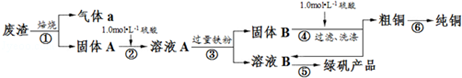

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
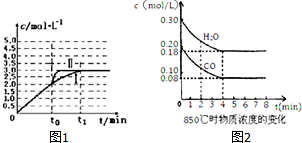
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为吸热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中仍充入1molA和1molB,反应达到平衡状态时,C的物质的量分数小于60% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CrO42-和S2-在酸性溶液中可大量共存 | |
| B. | 实验②说明氧化性:Cr2O72->SO42- | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3+3H+ | |
| C. | 90℃时,测得纯水中Kw=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| D. | 用热的纯碱溶液可以清洗油污:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| C. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)═2CO(g);△H2.则△H1<△H2 |
查看答案和解析>>
科目: 来源: 题型:解答题

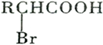
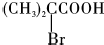 ;
; ,该反应类型为取代反应;
,该反应类型为取代反应;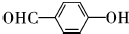 ;
;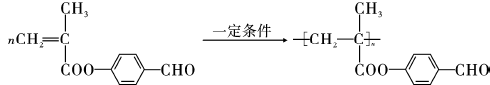 ;
;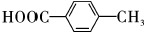 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com