
科目: 来源: 题型:选择题
| A. | 18gH2O中含有的质子数为10NA | |
| B. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| C. | 46g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有单质参加的化合反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
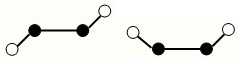
 ,有关该晶体的说法正确的是
,有关该晶体的说法正确的是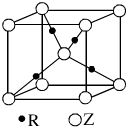
查看答案和解析>>
科目: 来源: 题型:解答题
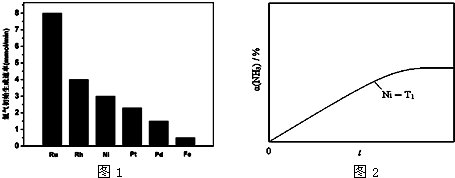
查看答案和解析>>
科目: 来源: 题型:解答题
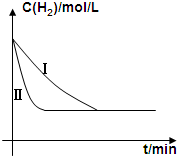 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
科目: 来源: 题型:选择题
 恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )| A. | x+y>z+m | |
| B. | 对反应体系加压v正>v逆 | |
| C. | 该反应正反应方向为热反应 | |
| D. | 对反应体系降低温度达平衡前v逆>v正 |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.一定温度下,在容积为2L的甲、乙、丙三个恒温密闭容器中,充入的SO2(g)和O2(g)的量如图所示:| A. | 三个容器中的反应速率相同 | |
| B. | 丙中的平衡常数最大,甲中最小 | |
| C. | 当容器甲中SO2的转化率为80%时,该反应的平衡常数为160 | |
| D. | 达到平衡时,容器丙中的c(SO3)是容器甲中的两倍 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
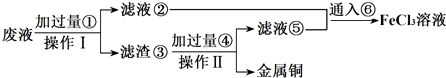
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com