
科目: 来源: 题型:解答题
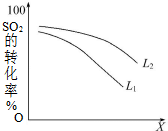 一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当该电池消耗1mol锌时,与CH4燃料电池消耗0.25molCH4产生电量相等 | |
| B. | 该电池二氧化锰为正极,发生氧化反应 | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
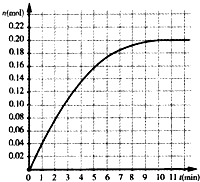 恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是( )
恒温条件下,往容积为2L的密闭容器内加入0.4mol的N2和1.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),反应中NH3物质的量变化情况如图:下列说法不合理的是( )| A. | 其它条件不变,若改用5L容器达到平衡需要的时间将大于10min | |
| B. | N2平衡转化率为25% | |
| C. | 平衡时气体总压强为开始时的90% | |
| D. | 反应前10min反应速率v(H2)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定温度下,向纯水中加入少量盐酸,[H+]增大,Kw将增大 | |
| B. | 25℃时,将pH=9的烧碱溶液稀释1000倍所得到的溶液,PH=6 | |
| C. | 25℃时,水的离子积常数Kw为1×10-14mol2•L-2 | |
| D. | 100℃时,纯水的pH=6,此时溶液呈酸性 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com