
科目: 来源: 题型:选择题
| A. | 标准状况下,1mol H2完全燃烧生成气态水放出285.8kJ热量,则H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后最高温度 | |
| C. | 在101 kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6g CO和22.4LCO2中含有的碳原子数一定相等 | |
| B. | ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L M气体分子的质量为16g,则M气体的摩尔质量是32 | |
| D. | 现有CO、CO2、O3三种气体,它们均含有1 molO,则三种气体的物质的量之比为3:2:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Cl中有离子键,是离子化合物 | |
| B. | 46g C2H5OH燃烧放出的热量为乙醇的燃烧热 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L0.1mol•L-1的氨水中含有的NH3分子数为0.1NA | |
| B. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA | |
| D. | 标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na→NaOH→Na2CO3 | B. | NaCl→Cl2→Fe Cl3 | ||
| C. | CO→CO2→C | D. | Al2O3→Al(OH)3→AlCl3 |
查看答案和解析>>
科目: 来源: 题型:解答题
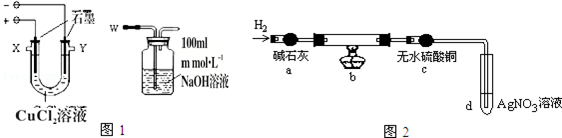
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
科目: 来源: 题型:解答题
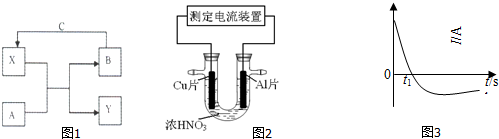
查看答案和解析>>
科目: 来源: 题型:解答题
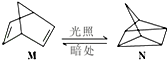
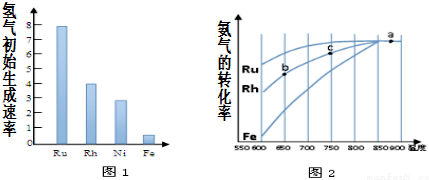
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com