
科目: 来源: 题型:选择题
| A. | 当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | |
| B. | 当溶液中c(CH3COO-)=c(Na+)时,一定是氢氧化钠过量 | |
| C. | 当溶液中c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全反应 | |
| D. | 当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
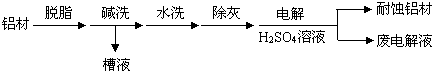

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 80gCuO和Cu2S的混合物含有的Cu原子数一定是NA | |
| B. | 标准状况下,5.6L O2作为氧化剂时转移的电子数一定为NA | |
| C. | 常温常压下,14g C2H4和C3H6混合气体中含有的原子数为3NA | |
| D. | 25℃,1LpH=13的NaOH溶液中含有OH-的数目为 0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
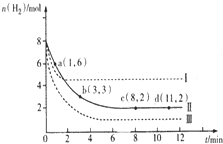 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com