
科目: 来源: 题型:解答题
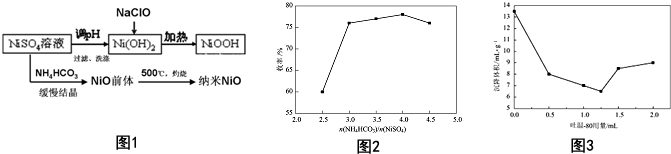
查看答案和解析>>
科目: 来源: 题型:选择题
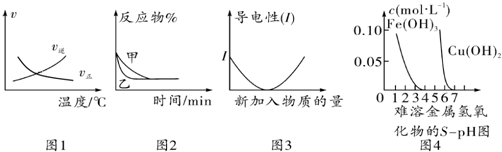
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池中负极发生还原反应 | |
| B. | 可充电电池充电时负极连接外加电源的负极 | |
| C. | 铁制品上电镀铜时铜作阴极 | |
| D. | 原电池工作时盐桥中阳离子流向负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+ | B. | 还原性:Br->Cl- | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 酸性:H2SO4>H3PO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
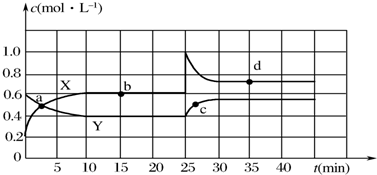
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨的喷泉实验:圆底烧瓶 | B. | 实验室制氧气:试管 | ||
| C. | 中和滴定:锥形瓶 | D. | 中和滴定:滴定管 |
查看答案和解析>>
科目: 来源: 题型:解答题
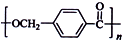 的路线:
的路线: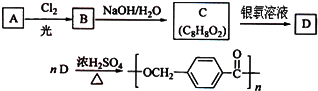

 .
. ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是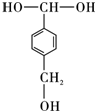 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
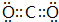 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com