
科目: 来源: 题型:解答题
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2(g) | △H3 | K3 | |||
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | C1 | C2 | C3 |
| 反应体系的能量变化 | aKJ | bKJ | cKJ | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | a1 | a2 | a3 | |
查看答案和解析>>
科目: 来源: 题型:选择题
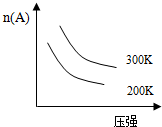
| A. | 3A(g)+B(g)?2C(g);△H<0 | B. | A(g)+3B(s)+2C(g)?3D(g);△H<0 | ||
| C. | C(s)+D(g)?A(g)+B(g)△H>0 | D. | 2C(g)?2A(g)+B(g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
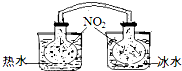 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加热 | B. | 使用催化剂 | C. | 加压 | D. | 分离出D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 双键、三键中都含有π键 | |
| B. | 成键原子间原子轨道重叠愈多,共价键愈牢固 | |
| C. | 因每个原子未成对的电子数是一定的,故与其配对的原子个数也一定 | |
| D. | 所有原子轨道在空间中都有自己的方向性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含MnO2的分散系中,K+、H2O2、S、Br--可以大量共存 | |
| B. | MnO2和浓盐酸反应的离子方程式:4HCl+MnO2═2Cl-+Cl2↑+Mn2++2H2O | |
| C. | MnO2在高锰酸钾的分解反应中是氧化产物 | |
| D. | 1 mol MnO2和参与反应:3MnO2+4Al═3Mn+2Al2O3,转移4 mol电子 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸氢钠 | B. | 明矾 | C. | 碳酸氢钠 | D. | 醋酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com