
科目: 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硝酸银溶液中加入铁粉:Ag++Fe═Fe2++Ag | |
| C. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| D. | 碳酸镁与稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
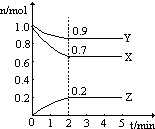 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3中含有O数目为3.0NA | |
| B. | 常温常压下,12.2gNaHSO4中含有离子总数为0.3NA | |
| C. | 在1L 0.1mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目: 来源: 题型:多选题
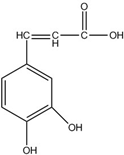
| A. | 分子式为C9H5O4 | |
| B. | 1mol该有机物最多可与3mol氢气发生加成反应 | |
| C. | 与溴水既能发生取代反应,又能发生加成反应 | |
| D. | 能与Na2CO3溶液反应,也能与NaHCO3溶液反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④ | B. | ②④ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | Fe3+肯定不存在 | |
| B. | 无色气体甲不一定是纯净物 | |
| C. | K+、Mg2+、Al3+和SO42-一定存在于溶液X中 | |
| D. | 白色沉淀乙肯定不是Al(OH)3和H2SiO3的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com