
科目: 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 反应③中1mol还原剂反应,则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目: 来源: 题型:多选题
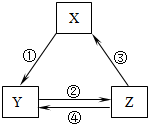 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z |
| A | CaO | Ca(OH)2 | CaCO3 |
| B | AlCl3 | NaAlO2 | Al(OH)3 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| B. | 22.4LHCl中的分子数为NA | |
| C. | Na2O2与水充分作用生成0.1molO2时转移的电子数为0.2NA | |
| D. | 0.1mol铁与足量盐酸反应转移的电子数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
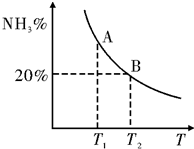 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com