
科目: 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①②④⑥ | C. | ①②③⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ/mol | |
| B. | CH3OH转变成H2的过程不一定要吸收能量 | |
| C. | 根据①②推知反应:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.9 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2FeO4溶液显强碱性,能消毒杀菌 | |
| B. | Na2FeO4具有强氧化性,能消毒杀菌 | |
| C. | Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水 | |
| D. | Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水 |
查看答案和解析>>
科目: 来源: 题型:解答题
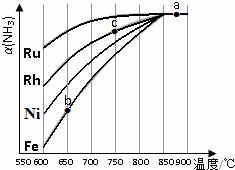 氨气在生产、生活和科研中应用十分广泛
氨气在生产、生活和科研中应用十分广泛查看答案和解析>>
科目: 来源: 题型:解答题
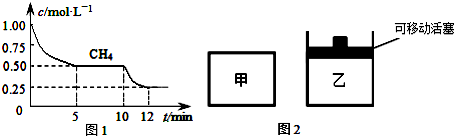
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目: 来源: 题型:解答题
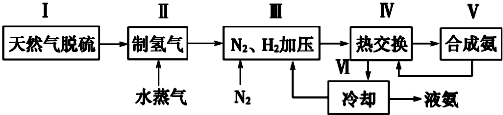
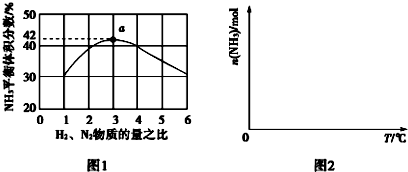
查看答案和解析>>
科目: 来源: 题型:解答题
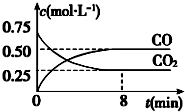 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:查看答案和解析>>
科目: 来源: 题型:选择题
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10 min内反应的平均速率为 v(C)=0.050 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)>0.25 mol | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com