
科目: 来源: 题型:选择题
| A. | MgO固体(SiO2),加过量NaOH溶液充分反应,过滤、洗涤、干燥 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水溶解、蒸发、结晶、过滤、洗涤、干燥 | |
| D. | FeCl3溶液(CuCl2),过量铁粉,过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
查看答案和解析>>
科目: 来源: 题型:解答题
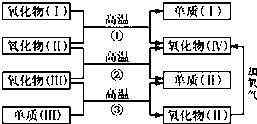 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
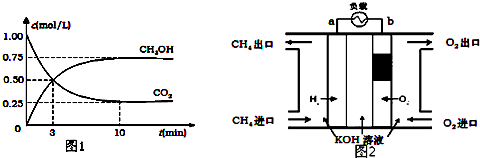
查看答案和解析>>
科目: 来源: 题型:解答题
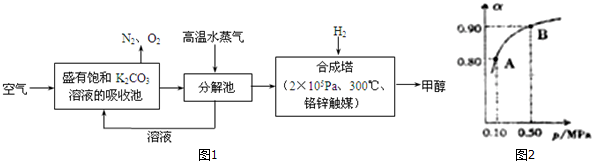
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若M(甲)>M(乙),则分子数:甲>乙 | B. | 若M(甲)<M(乙),则气体摩尔体积:甲>乙 | ||
| C. | 若M(甲)<M(乙),则气体的压强:甲>乙 | D. | 若M(甲)>M(乙),则气体体积:甲<乙 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化剂的作用 | B. | 还原剂的作用 | C. | 催化剂的作用 | D. | 吸附剂的作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成的难易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 | H2、Br2混合,加热时发生化合 | H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
| A. | 同周期元素的金属性随原子序数递增而增强 | |
| B. | 同周期元素的非金属性随原子序数递增而增强 | |
| C. | 第VIIA族元素的非金属性随电子层数的增加而减弱 | |
| D. | 第VIIA族元素的金属性随电子层数增加而减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com