
科目: 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>H2SiO3 | ||
| C. | 碱性:NaOH>LiOH | D. | 热稳定性:HF>HBr |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| B. | 点燃爆竹后,硫燃烧生产SO3 | |
| C. | 海水中含有溴元素,只进行物理变化就可以得到溴单质 | |
| D. | “地沟油”禁止使用,但可以用来制取肥皂 |
查看答案和解析>>
科目: 来源: 题型:解答题
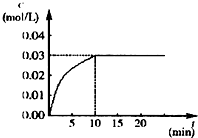 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 84% | B. | 50% | C. | 16% | D. | 39% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
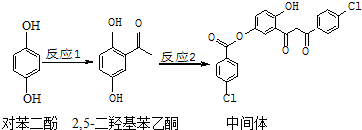
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | KOH溶液与AlCl3溶液 | B. | AlCl3溶液与氨水 | ||
| C. | NaAlO2溶液与盐酸 | D. | NaHCO3溶液与盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
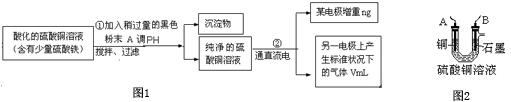
查看答案和解析>>
科目: 来源: 题型:解答题
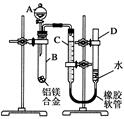 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com