
科目: 来源: 题型:选择题
| A. | H2SO4、HClO、BaCO3是电解质 | |
| B. | 生石灰与水混合发生化学、物理变化 | |
| C. | 丁达尔效应可以区分溶液与胶体 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
科目: 来源: 题型:解答题
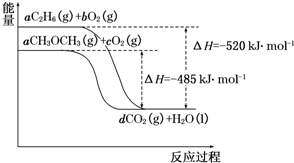 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.如图是乙烷(C2H6)、二甲醚(CH3OCH3)燃烧过程的能量变化图.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
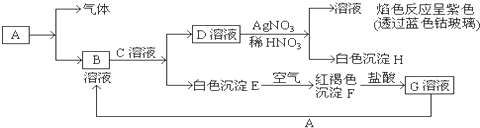
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可用电解熔融CeO2制取金属铈,铈在阳极生成 | |
| B. | 58138Ce、58142Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+═Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
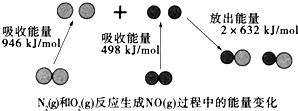
| A. | 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| B. | 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | | |
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol过氧化钠中阴离子数目为2NA | |
| B. | 1mol氯气与足量的NaOH溶液反应,转移电子的数目为2 NA | |
| C. | 标准状况下,11.2L氨水含有0.5 NA个NH3分子 | |
| D. | 9g水中含有5 NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com