
科目: 来源: 题型:多选题
| A. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| B. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目: 来源: 题型:填空题
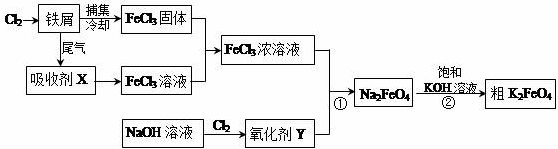
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用氢氧化钠溶液中和稀硝酸:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 铜与硝酸银溶液的反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3产生的CO2多 | |
| B. | 等物质的量的盐酸分别与足量的Na2CO3和NaHCO3反应,Na2CO3产生的CO2多 | |
| C. | 相同温度在水中的溶解度:Na2CO3大于NaHCO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,消耗盐酸的量一样多 |
查看答案和解析>>
科目: 来源: 题型:解答题
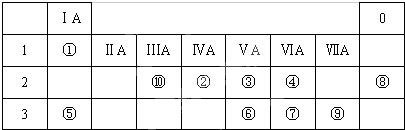
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com