
科目: 来源: 题型:选择题
| A. | 等于10s | B. | 等于12s | C. | 小于12s | D. | 大于13s |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaA的溶液呈碱性 | B. | pH=2的HA溶液稀释100倍后pH=3.5 | ||
| C. | 0.01 mol•Lˉ1HA溶液的pH=4 | D. | HA溶液跟锌反应,放出H2很慢 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 物质 | 试剂或操作名称 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:MgO(Al2O3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:NaCl、KCl | |
| ⑤ | 鉴别:AlCl3、Al2(SO4)3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
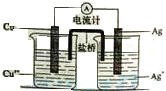 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用.回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑦ | C. | ②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在合成氨的反应中,高温、高压有利于氨的合成 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 保存FeSO4溶液时需要往里加入光亮的铁钉 | |
| D. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com