
科目: 来源: 题型:选择题
| A. | a-b+2 | B. | $\frac{N(a-b-2)}{a}$ | C. | $\frac{N(a-b+2)}{a}$ | D. | a-b-2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
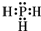 ;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.
;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液态植物油通过催化加氢可制得人造奶油 | |
| B. | 饱和(NH4)2SO4溶液可使蛋白质变性 | |
| C. | 淀粉和蛋白质的组成元素相同 | |
| D. | 石蜡油经分馏可以获得乙烯 |
查看答案和解析>>
科目: 来源: 题型:解答题
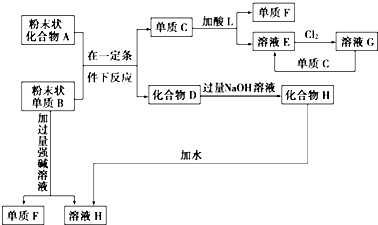
查看答案和解析>>
科目: 来源: 题型:解答题
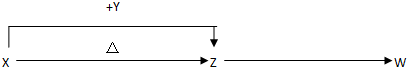
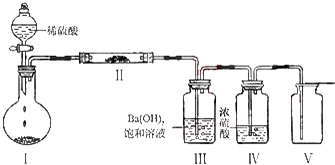
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体型 | |
| B. | 在SCl2中,中心原子S采取sp杂化轨道成键 | |
| C. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| D. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
查看答案和解析>>
科目: 来源: 题型:解答题
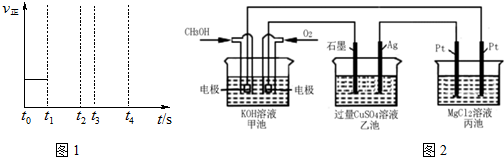
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com