
科目: 来源: 题型:解答题
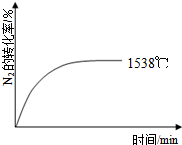 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目: 来源: 题型:解答题
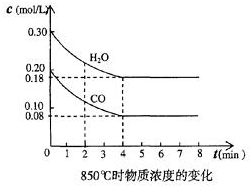 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示正反应程度越大反应进行越完全,反应的转化率越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.38 | 0.238 | 0.062 | 0.062 |
| 3 | c | c2 | c3 | c3 |
| 4 | c | c2 | c3 | c3 |
| 5 | 0.6 | 0.26 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应开始时的速率:甲=乙 | |
| B. | 反应所需时间:甲<乙 | |
| C. | 反应开始时,酸的物质的量浓度:乙<甲 | |
| D. | 反应结完后溶液的pH值:甲<乙 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯水中c(H+)•c(OH-)=1×10-14 | B. | 25℃纯水中c(H+)•c(OH-)=1×10-14 | ||
| C. | 25℃稀盐酸中c(H+)•c(OH-)=1×10-14 | D. | KW值随温度升高而增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 任何反应中的能量变化都表现为热量变化 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 所有化学反应都可以设计成原电池 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的原子L层电子数是K层电子数的2倍 |
| Y | Y是短周期元素中原子半径最大的元素(除稀有气体元素外) |
| Z | Z的原子最外层电子数等于电子层数 |
| W | W原子最外层电子数是X、Z原子最外层电子数之和 |
 ,X的气态氢化物电子式为
,X的气态氢化物电子式为 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
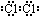 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为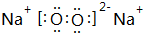 .
.查看答案和解析>>
科目: 来源: 题型:多选题
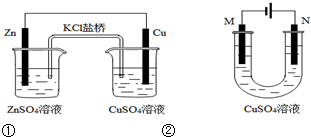
| A. | 装置①中盐桥内的K+移向CuSO4溶液 | |
| B. | 装置①将电能转变为化学能 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则N极为粗铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com