
科目: 来源: 题型:选择题
| A. | 单质的沸点:Y<X | B. | 简单离子半径:Y<Z | ||
| C. | 盐M的水溶液显酸性 | D. | 最高化合价:X>Y>Z |
查看答案和解析>>
科目: 来源: 题型:解答题
| A | B | C | D | |
| A | - | - | ↑ | |
| B | - | ↓ | ↓ | |
| C | - | ↓ | - | |
| D | ↑ | ↓ | - |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2H++2e→H2↑ | B. | 2H20+2C1-→H2↑+C12↑+20H- | ||
| C. | 2Cl--2e→Cl2↑ | D. | 2H20+2NaCl→H2↑+Cl2↑+2Na0H |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 用碳酸钠溶解鉴别乙醇、乙酸和乙酸乙酯 | |
| C. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下,46gNO2和N2O4的混合气体中含有NA个氮原子 | |
| B. | 1mol12C18O2中所含的中子数为26NA | |
| C. | 常温下,1L0.1mol/LCH3COONa溶液中含有CH3COO-和Na+总数为0.2NA | |
| D. | 常温下,1LpH=12的氨水中含有OH-的数目为0.01NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、Br- | B. | SO32-、Al(OH)4-、K+、Al3+ | ||
| C. | Fe3+、Na+、NO3-、CO32- | D. | NH4+、Na+、SiO32-、I- | ||
| E. | Ca2+、Na+、NO3-、PO43- |
查看答案和解析>>
科目: 来源: 题型:解答题
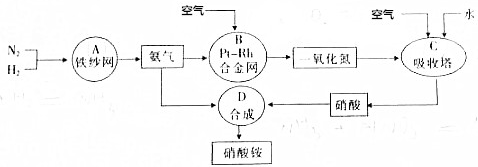
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
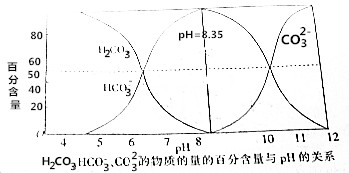
| A. | 碳酸溶液中:c(H+)>c(HCO3-) | |
| B. | pH=8.35的钠盐溶液中:c(H2CO3)+c(H+)=c(CO32-)+c(OH-) | |
| C. | 在Na2CO3和NaHCO3的混合溶液中,若c(CO32-)=c(HCO3-),则c(Na+)+c(H+)=3c(HCO3-)+c(OH-) | |
| D. | pH=12的钠盐溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com