
科目: 来源: 题型:选择题
| A. | KCl中含有35Cl | |
| B. | 生成物Cl2的平均相对分子质量为73.3 | |
| C. | 1molK35ClO3参加反应,失去电子数为5NA | |
| D. | 氧化剂和还原剂的物质的量之比1:6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、Na+、ClO、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Mg2+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制乙酸乙酯时,不断的蒸出乙酸乙酯来提高产率 | |
| B. | CO有毒,会与血液中血红蛋白(用Hb表示)化合发生下述反应:CO+HbO2?HbCO+O2,输氧抢救CO中毒的患者 | |
| C. | 皂化反应采用强碱性条件,促使油脂水解 | |
| D. | 合成氨时,采用高温与高压来提高氨气的产率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯净的甲烷在空气中燃烧可看到黄色火焰,用涂有澄清石灰水的小烧杯照在火焰上方,烧杯内壁变浑浊 | |
| B. | 检测孙老师是否酒后驾车,交警同志可用装有K2Cr2O7酸性试剂的吹气检测仪检测,看到检测仪由橙色变为绿色,说明孙老师酒后驾车应当进行处罚 | |
| C. | 科学探究:小米在家用食醋浸泡鸡蛋,观察到鸡蛋壳表面没有产生气泡,说明食醋主要成分乙酸没有酸性 | |
| D. | 天然纤维,人造纤维,合成纤维中均含有纤维素 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
查看答案和解析>>
科目: 来源: 题型:解答题
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
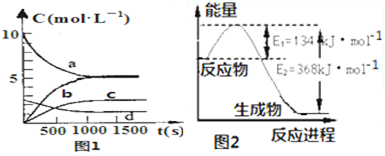
查看答案和解析>>
科目: 来源: 题型:解答题
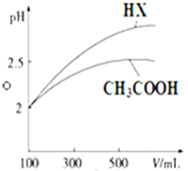 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com