
科目: 来源: 题型:填空题
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
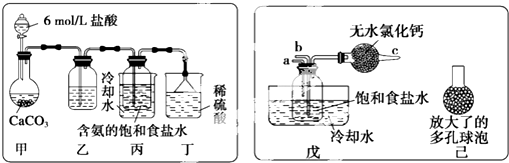
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
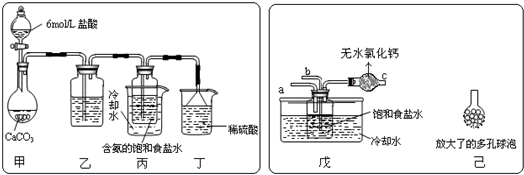
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
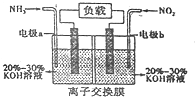
查看答案和解析>>
科目: 来源: 题型:解答题
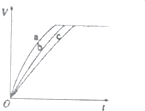 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
查看答案和解析>>
科目: 来源: 题型:填空题
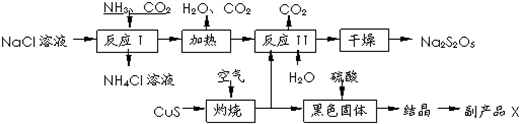
查看答案和解析>>
科目: 来源: 题型:选择题
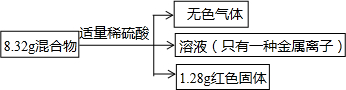
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com