
科目: 来源: 题型:选择题
| A. | 达到化学平衡时,v正=v逆=0 | |
| B. | 化学反应速率关系是2v(NH3)=3v(H2O) | |
| C. | 达到化学平衡时,O2的浓度不再改变 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| C. | 苯与浓硝酸、浓硫酸混合共热制取硝酸苯是发生取代反应 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:解答题
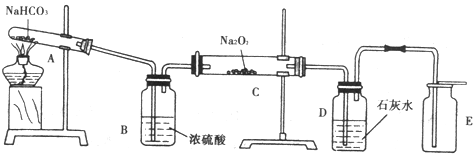
查看答案和解析>>
科目: 来源: 题型:选择题
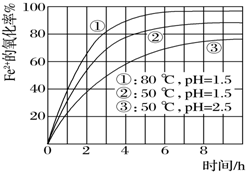 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制纯碱:往NaOH溶液中 通入少量CO2气体,再蒸发溶液 | |
| B. | 制氯气:以粗盐为原料,经过除杂、浓缩得饱和食盐水,再进行电解所得溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,再用H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
查看答案和解析>>
科目: 来源: 题型:填空题
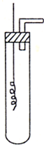 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.查看答案和解析>>
科目: 来源: 题型:选择题
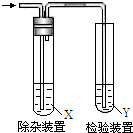 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )| 小组 | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com