
科目: 来源: 题型:解答题
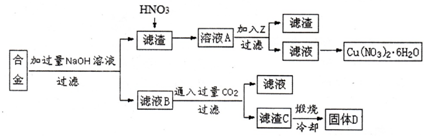
查看答案和解析>>
科目: 来源: 题型:解答题
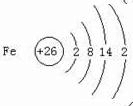 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.查看答案和解析>>
科目: 来源: 题型:多选题
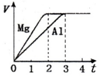 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系| A. | 物质的量之比为3:2 | B. | 质量之比为2:3 | ||
| C. | 摩尔质量之比为2:3 | D. | 反应速率之比为3:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 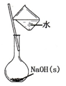 配置0.10mol/LnaOH溶液 | |
| B. | 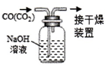 除去CO中的CO2 | |
| C. | 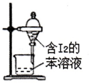 苯萃取碘水中的I2,分出水层后的操作 | |
| D. | 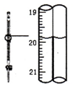 记录滴定终点读数为19.80mL |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 甲学生用50mL量筒量取46.70mL浓盐酸 | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生配NaOH溶液,用电子天平称取固体1.220g | |
| D. | 丁学生用红柄滴定管量取25.00mL0.1mol/L的盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;画出碳原子结构示意图
;画出碳原子结构示意图 ;氧元素位于周期表第周期第VIA族.
;氧元素位于周期表第周期第VIA族.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每摩尔H2O2分子含2NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 16g甲烷分子中含4NA个氢原子 | |
| D. | 100mL 1mol/L Na2SO4溶液含有0.2NA个Na+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镁带中混有与酸不反应的杂质 | |
| B. | 装置接口连接处有气体泄漏 | |
| C. | 液体量瓶刻度读数未扣去硫酸的体积 | |
| D. | 硫酸注入量不足,镁带未反应完全 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定前,没有逐出滴定管下口的气泡 | |
| B. | 用甲基橙作指示剂,指示剂刚变色,就停止滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 | |
| D. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制FeSO4溶液时,加入一些铁粉 | |
| B. | 500℃左右比室温更有利于合成氨的反应 | |
| C. | 实验室常用排饱和食盐水的方法收集氯气 | |
| D. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com