
科目: 来源: 题型:解答题
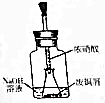 我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].
我国历史悠久,文明发达,早在商代就会冶练铜器,在出土的各代铜器表面都为绿色.经科学家检验,这些铜器都为碱式碳酸铜[Cu2(OH)2CO3].查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=3的醋酸溶液稀释100倍后,溶液的pH=5 | |
| B. | pH=2的盐酸与等体积0.01mol•L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) | |
| C. | 0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH-)+c(HCO3-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素A的一种单质是太阳能电池中的主要材料 | |
| B. | 元素C的某单质与过氧化钠的漂白原理类似 | |
| C. | B和E可组成一种耐高温的结构材料,其化学式为E4B3 | |
| D. | 工业上制取E单质时,生成的气体主要是AO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ba2+、SO42-、Cl- | B. | K+、OH-、HCO3- | C. | Mg2+、SO42-、Cl- | D. | Cu2+、H+、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色溶液中:Al3+、NH4+、Cl-、HS- | |
| B. | Na2CO3溶液中:K+、NH4+、SO42-、Cl- | |
| C. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的水溶液中:Ca2+、HCO3-、I-、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
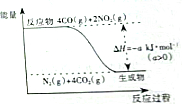 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com