
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
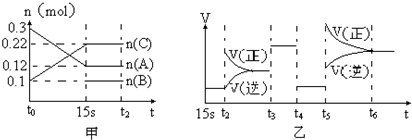
查看答案和解析>>
科目: 来源: 题型:解答题
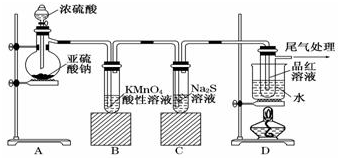
查看答案和解析>>
科目: 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
科目: 来源: 题型:解答题
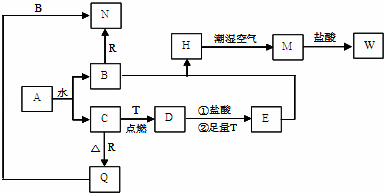
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
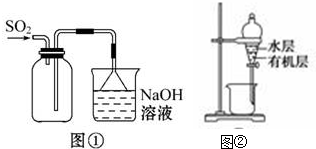
| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 用图②所示装置,分离CCl4萃取I2水后的有机层和水层 | |
| C. | 除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤 | |
| D. | 称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol•L-1的NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①⑤⑥ | C. | ①③④⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,甲烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| D. | 苯酚能与溴水反应,而苯不能与溴水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com