
科目: 来源: 题型:解答题
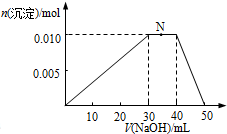
 实验小组为探究SO2的漂白性和还原性,设计了以下实验.
实验小组为探究SO2的漂白性和还原性,设计了以下实验.查看答案和解析>>
科目: 来源: 题型:解答题
 H、C、N、O、Al、S是常见的六种元素.
H、C、N、O、Al、S是常见的六种元素.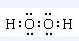 或H:C??C:H.
或H:C??C:H.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
| B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
| C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
| D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
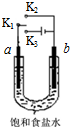 用如图装置研究电化学原理,下列分析中错误的是( )
用如图装置研究电化学原理,下列分析中错误的是( )| 选项 | 连接 | 电极材料 | 分析 | |
| a | b | |||
| A | K1 K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
| B | K1 K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
| C | K1 K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
| D | K1 K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-→Al(OH)3↓ |
| D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6 kJ/mol查看答案和解析>>
科目: 来源: 题型:解答题
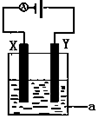
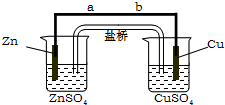 某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 硝酸与金属反应时,只表现出氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸 | |
| B. | 浓硫酸具有吸水性,故能使蔗糖碳化 | |
| C. | 浓硫酸和铜片加热既表现出酸性,又表现出氧化性 | |
| D. | 浓H2SO4可做H2、O2等气体的干燥剂表现其脱水性 |
查看答案和解析>>
科目: 来源: 题型:解答题
 电池的发明和应用是化学家们对人类社会的重要贡献之一.
电池的发明和应用是化学家们对人类社会的重要贡献之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com