
科目: 来源: 题型:解答题
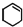 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):



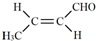 .
.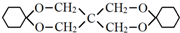 .
.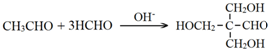 .
.查看答案和解析>>
科目: 来源: 题型:解答题
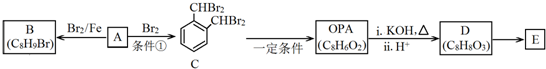
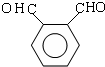 .
.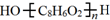 .D→E的化学方程式是n
.D→E的化学方程式是n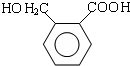 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$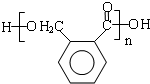 +(n-1)H2O(不必注反应条件).
+(n-1)H2O(不必注反应条件).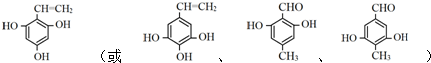 (写1种即可).
(写1种即可).查看答案和解析>>
科目: 来源: 题型:解答题
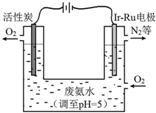 过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.
过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸.查看答案和解析>>
科目: 来源: 题型:解答题
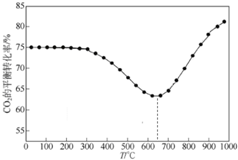 CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
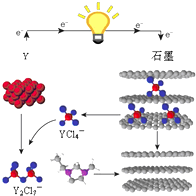 X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.
X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 亚硫酸盐作为食品添加剂作用是防腐保鲜 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
查看答案和解析>>
科目: 来源: 题型:选择题
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用Cl2表示的反应速率为0.9mol/(L•min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
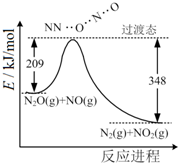
| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com