
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
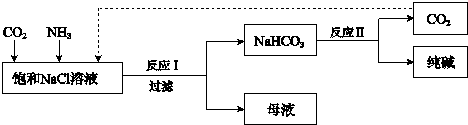
 2NH3.
2NH3.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2+2H2O═2Na++2OH-+H2↑ | B. | 2O22-+4H+═4OH-+O2↑ | ||
| C. | Na2O2+2H2O═2Na++2OH-+O2↑ | D. | 2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸有氧化性,稀硫酸无氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验装置 | 编号 | 溶液X | 实验现象 |
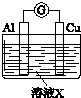 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
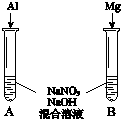 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com