
科目: 来源: 题型:解答题
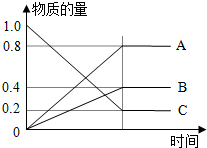 H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).查看答案和解析>>
科目: 来源: 题型:解答题
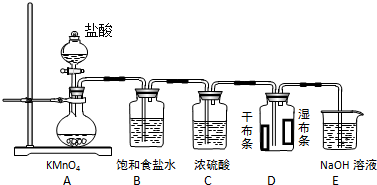
查看答案和解析>>
科目: 来源: 题型:解答题
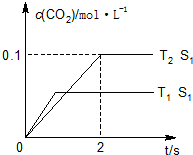 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.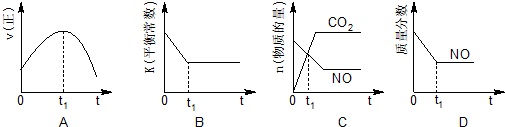
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| C. | 对于有气体参加的反应,增大压强,反应速率加快 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
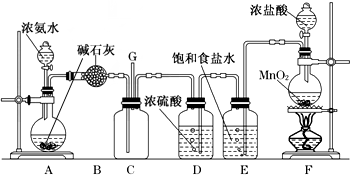
查看答案和解析>>
科目: 来源: 题型:解答题
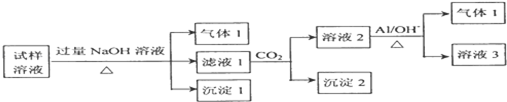
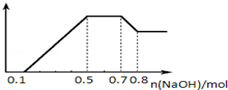
查看答案和解析>>
科目: 来源: 题型:解答题
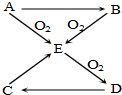 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com