
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3溶液和Ca(OH)2溶液 | B. | Na2O和H2O | ||
| C. | Na2SO4溶液和CuCl2溶液 | D. | Na和NaCl溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
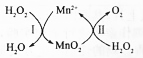 MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:
MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
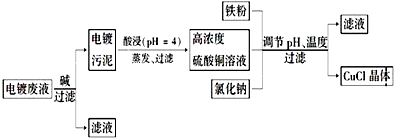
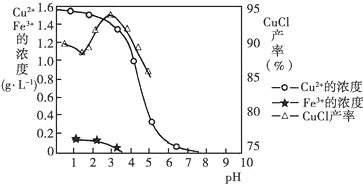
查看答案和解析>>
科目: 来源: 题型:解答题
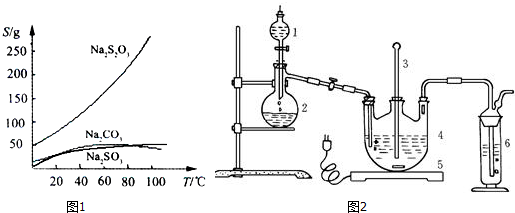
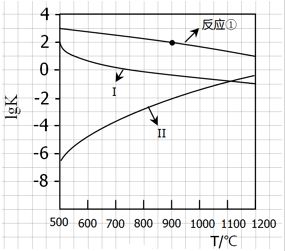 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.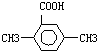 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. | 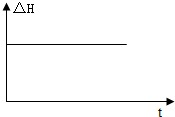 | ||
| C. |  | D. |  |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每转移0.1mol电子,理论上生成20.7g Pb | |
| B. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| C. | 正极反应式:Pb2++2e-═Pb | |
| D. | 放电过程中,Li+向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com