
科目: 来源: 题型:选择题
| A. | 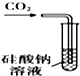 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 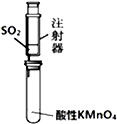 乙装置:可用来检验二氧化硫气体 | |
| C. | 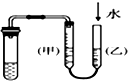 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. |  丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
查看答案和解析>>
科目: 来源: 题型:选择题
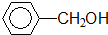 酚类-OH
酚类-OH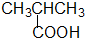 羧酸类-COOH
羧酸类-COOH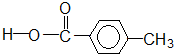 醛类
醛类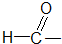
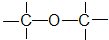
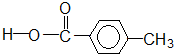 酯类
酯类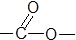
| A. | ①②③④⑤ | B. | ②④ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
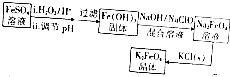
查看答案和解析>>
科目: 来源: 题型:解答题
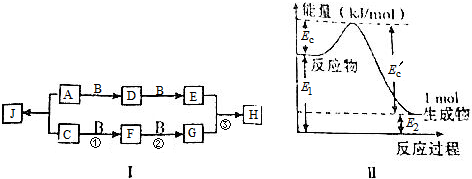
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24LNO2分子总数小于0.1NA | |
| B. | 50ml,18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
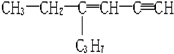 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )| A. | 5,6,4 | B. | 5,3,6 | C. | 5,4,8 | D. | 5,3,5 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaClO溶液通入少量SO2气体:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 将过量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氢钙溶液滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com