
科目: 来源: 题型:多选题
| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
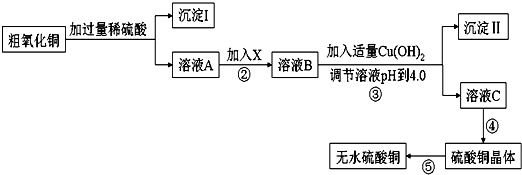
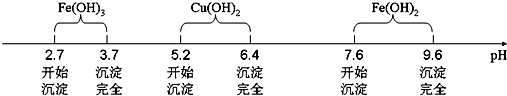
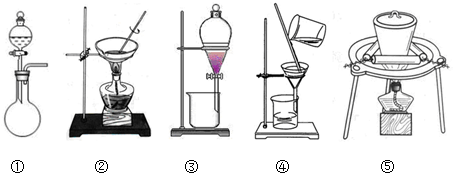
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
科目: 来源: 题型:选择题
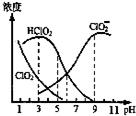
| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$═$\frac{1}{10}$ | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c( ClO2-)>c( ClO2)>c( Cl-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
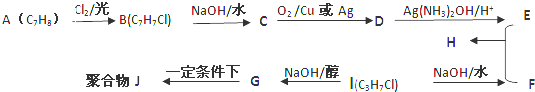
 ,D的官能团名称醛基.
,D的官能团名称醛基. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. +CH3CH(OH)CH3$→_{△}^{浓硫酸}$
+CH3CH(OH)CH3$→_{△}^{浓硫酸}$ +H2O.
+H2O.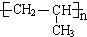 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1 mol•L-1 HCN溶液的pH约为3 | |
| B. | HCN易溶于水 | |
| C. | 10 mL 1 mol•L-1 HCN溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应是分解反应 | B. | 该反应的熵增效应大于焓变效应 | ||
| C. | 该反应是熵减反应 | D. | 该反应是放热反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 23 g钠在氧气中完全燃烧失电子数为0.5NA | |
| B. | 标准状况下,22.4 L苯所含的分子数 | |
| C. | 室温下,8 g甲烷含有共价键数为2NA | |
| D. | 1 L 1 mol•L-1硫酸溶液所含的H+数 |
查看答案和解析>>
科目: 来源: 题型:解答题
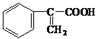 )和甲醇反应制得.
)和甲醇反应制得.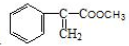
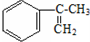 经过四步不同类型的反应制得阿托酸.
经过四步不同类型的反应制得阿托酸.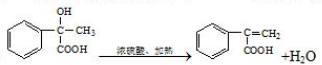 .
.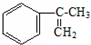 多两个碳原子的一种同系物,且A的所有碳原子可以处于同一平面上.写出A的结构简式
多两个碳原子的一种同系物,且A的所有碳原子可以处于同一平面上.写出A的结构简式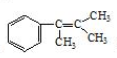 .
.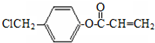 是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为
是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为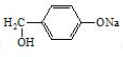 、
、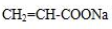 .
.查看答案和解析>>
科目: 来源: 题型:解答题

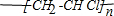
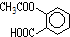 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com