
科目: 来源: 题型:解答题
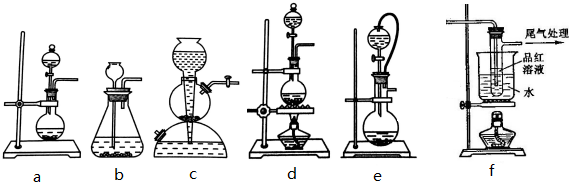

查看答案和解析>>
科目: 来源: 题型:解答题
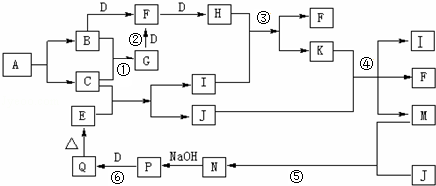
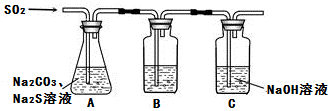
查看答案和解析>>
科目: 来源: 题型:解答题
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | C=$\frac{1000a}{22.4V}$mol/L | |
| C. | 可用装置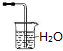 吸收氨气 吸收氨气 | |
| D. | 上述溶液中再加入VmL水,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目: 来源: 题型:选择题
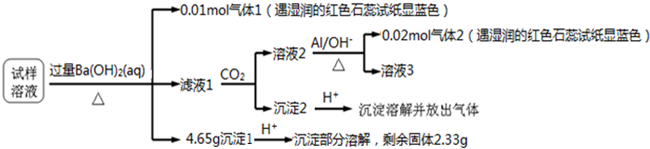
| A. | 沉淀2为氢氧化铝 | |
| B. | Cl-一定存在,且c(Cl?)≥0.05mol | |
| C. | 该试样溶液中一定存在的离子有NH4+、Mg2+、Al3+、SO42-和NO3- | |
| D. | 试样中可能存在Na+、Cl-、Al3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝片溶于过量的氢氧化钠溶液:Al+4OH-═AlO2-+2H2O | |
| B. | 0.01mol/LNH4Al(SO4)2溶液和0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | $\frac{5000(2b-a)}{V}$mol/L | B. | $\frac{5(2b-a)}{V}$mol/L | C. | $\frac{(2b-a)}{V}$mol/L | D. | $\frac{1000(2b-a)}{V}$mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阳离子只能得电子被还原,阴离子只能失电子被氧化 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 已知还原性:B->C->D-,反应 2C-+D2═2D-+C2 和反应 2C-+B2═2B-+C2 都能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com