
科目: 来源: 题型:解答题
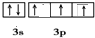 .
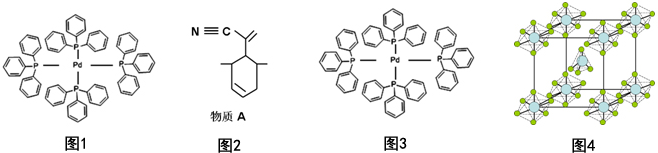
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应体系中Au2O是氧化剂 | |
| B. | Na2S4O6是还原产物 | |
| C. | 该反应体系中起还原作用的元素是Au2O中+1价的Au | |
| D. | 该反应体系中每转移2mol电子则消耗1molH2O |
查看答案和解析>>
科目: 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
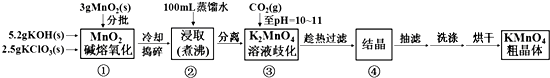
查看答案和解析>>
科目: 来源: 题型:解答题
 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和 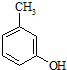 为原料制取.
为原料制取.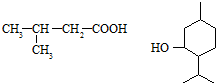 .
.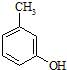 的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含
的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含 ).
). +CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$ 反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成
反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成 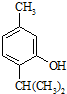 的量远大于生成
的量远大于生成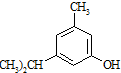 的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.
的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.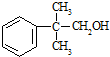 的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 )
的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 ) .
.查看答案和解析>>
科目: 来源: 题型:解答题
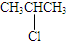 ③
③ ④
④ .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正反应活化能小于125.4kJ•mol-1 | |
| B. | 逆反应活化能一定小于125.4kJ•mol-1 | |
| C. | 逆反应活化能不小于125.4kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能大125.4kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水) | |
| D. | 0.1mol/L的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知H2R为二元弱酸:H2R?HR-+H+ Ka1 HR-?R2-+H+ Ka2
已知H2R为二元弱酸:H2R?HR-+H+ Ka1 HR-?R2-+H+ Ka2| A. | pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2R) | |
| B. | pH=2.7溶液中:c2(HR-)/[c(H2R)×c(R2-)]=1000 | |
| C. | 将相同物质的量KHR和K2R固体完全溶于水可配得pH为4.2的混合液 | |
| D. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
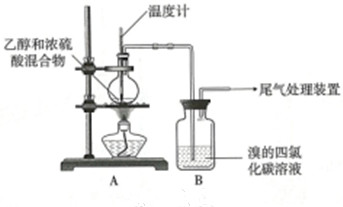
| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com